हेलो, दोस्तों आज की इस पोस्ट के माध्यम से, मैं आपको असामान्य आण्विक द्रव्यमान के बारे में जानकारी देने वाला हूँ, यदि आप जानकारी पाना चाहते हो तो पोस्ट को पूरा पढ़कर जानकारी प्राप्त कर सकते हो।
असामान्य आण्विक द्रव्यमान के बारे में
अणुसंख्य गुणधर्म (molecular properties) का उपयोग विलेय के आण्विक द्रव्यमान (molecular mass) के निर्धारण के लिए किया जा सकता है। आण्विक द्रव्यमान के निर्धारण के लिए प्रयुक्त होने वाले संबंध केवल विलयनो के आदर्श व्यवहार (ideal behavior) के लिए मान्य है। अणुसंख्य गुणधर्मो के प्रायोगिक आंकड़ों से प्राप्त आण्विक द्रव्यमानों के मान हमेशा सामान्य आण्विक द्रव्यमानों (common molecular masses) के बराबर नहीं होते हैं। इसके निम्न कारण होते हैं:
(1) विलेय के अणुओं का संगुणन
(2)विलेय के अणुओं का वियोजन
इन कारणों से अल्पसंख्य गुणधर्म (minority property) के प्रायोगिक आंकड़ों से गणना करने पर प्राप्त आण्विक द्रव्यमान सामान्य आण्विक द्रव्यमानों से भिन्न पाये जाते हैं। ये सामान्य आण्विक द्रव्यमानों (common molecular masses) से भिन्न आण्विक द्रव्यमान ही असामान्य आण्विक द्रव्यमान कहलाते हैं।
विलेय के अणुओं का संगुणन
कुछ पदार्थों के विलयनों, जैसे ऐसीटिक अम्ल का बेंजीन (benzene) में, बेंजोइक अम्ल का बेंजीन में, फिनाल का बेंजीन में आदि के लिए अणुसंख्य गुणधर्म के प्रायोगिक मान सामान्य मानो की अपेक्षा कम प्राप्त होते हैं। यह अपसामान्य व्यवहार तथ्य (abnormal behavior facts) द्वारा समझाया जा सकता है कि इन विलयनों में विलेय के अणु हाइड्रोजन बंधन के द्वारा संगुणित (completed) होकर बड़े अणु बना लेते हैं जिससे कणों (particles) की कुल संख्या में कमी हो जाती है।
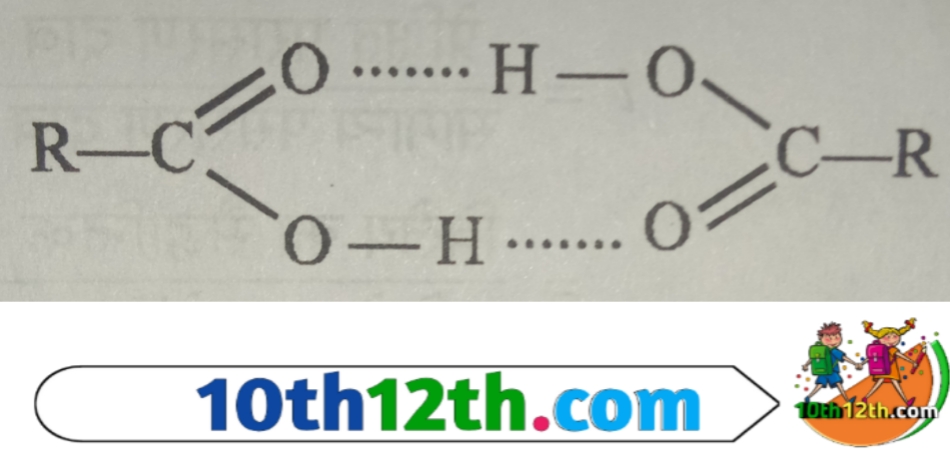
विलेय के कणों की संख्या में यह कमी ही अणुसंख्य गुणधर्म के निम्न मानो (lower values) के लिए उत्तरदाई है। अतः ऐसी स्थिति में प्रेक्षित आण्विक द्रव्यमान सामान्य आण्विक द्रव्यमान से अधिक होता है।
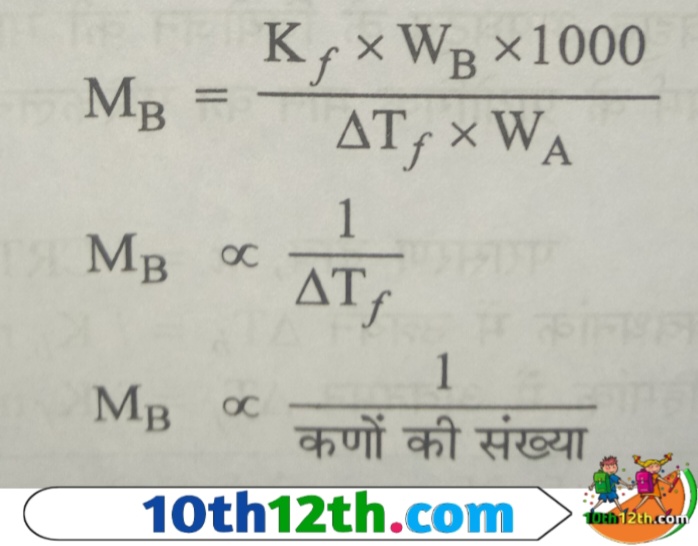
विलेय के अणुओं का वियोजन
KCl, BaCl₂, NaNO₃ तथा अन्य-वैधुत अपघटयो के जलीय विलयनों के अणुसंख्य गुणधर्म के प्रायोगिक मान सामान्य मानो से अधिक पाये जाते हैं। यह असंगति इस तथ्य के द्वारा समझायी जा सकती है कि ये पदार्थ विलयन में आयनित (ionized) हो जाते हैं, जिससे विलेय के कणों की संख्या बढ़ जाती है। संख्या में वृद्धि अणुसंख्य गुणधर्म (molecular properties) के उच्च मानों के लिए उत्तरदायी है।
चूंकि प्रत्येक अणु दो या दो से अधिक आयनों में वियोजित (disassemble) होता है, अतः यह स्पष्ट है कि प्रेक्षित आण्विक द्रव्यमान (observed molecular mass) सामान्य आण्विक द्रव्यमान से कम होगा। अतः विलेय के वियोजन या संगुणन (computation) के कारण उपरोक्त वर्णित की गयी विधियों द्वारा अपसामान्य आण्विक द्रव्यमान (abnormal molecular mass) प्राप्त होते हैं। अतः इस कथन को इस प्रकार प्रकट कर सकते हैं -

वाण्ट हाफ गुणांक
समान सांद्रता वाले विद्युत अपघटय और विद्युत अनपघटय के अणुसंख्य गुणधर्मो (colligative properties) की तुलना करने पर ज्ञात होता है कि विद्युत अपघटन का परासरण दाब, वाष्प दाब में कमी, हिमांक में अवनमन और क्वथनांक का उन्नयन वैद्युत अनपघटय (non electrolyte) पदार्थों की अपेक्षा अधिक होता है। वाण्ट हाफ ने इन दोनों प्रकार के पदार्थों के अणुसंख्य गुणधर्म को निम्न गुणांक (ᵢ) द्वारा व्यक्त किया, जिसे वाण्ट हाफ गुणांक (van't hoff factor) कहते हैं।

चूंकि अणुसंख्य गुणधर्म विलेय के आण्विक द्रव्यमान (molecular mass) के साथ व्यक्तुक्रम अनुपात में संबंधित होते हैं, इसलिए इस संबंध के आधार (base) पर एक नया संबंध स्थापित किया जा सकता है।

इन संबंधों की सहायता से विद्युत अपघटय (electrolytic) में के वियोजन की मात्रा ज्ञात की जा सकती है और यदि वियोजन (separation) की मात्रा ज्ञात हो, तो विलेय के अणुसंख्य गुणधर्म के प्रायोगिक मान (experimental value) का परिकलन किया जा सकता है। इसे संक्षेप में निम्न प्रकार प्रकट कर सकते हैं।


.webp)