नाइट्रोजन युक्त कार्बनिक यौगिकों के अपघटन से अमोनिया बनता है। इसी कारण यह वायुमंडल में भी उपलब्ध रहती है। वनस्पतियों तथा जीव-जंतुओं के सड़ने-गलने से इनके प्रोटीन का अपघटन हो जाता है और अमोनिया गैस उत्पन्न होती है जो वायुमंडल में मिल जाती है। यह कुछ पेड़ों में भी पाई जाती है। जीव धारियों के रक्त तथा मूत्र में यह गैस लवणों के रूप में पाई जाती है।
जोसेफ प्रीस्टले नामक वैज्ञानिक ने सन् 1774 ई. में अमोनियम क्लोराइड को चुने साथ गर्म करके अमोनिया की सर्वप्रथम खोज की थी।
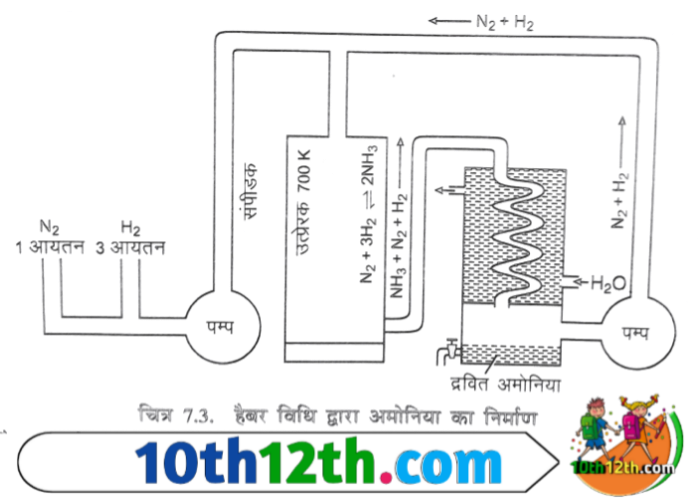
हैबर विधि का सिद्धांत
शुद्ध नाइट्रोजन और हाइड्रोजन के 1:3 अनुपात के मिश्रण को गर्म किया जाए तो अमोनिया बनती है।

यह एक ऊष्माक्षेपी उत्क्रमणीय अभिक्रिया है और क्रिया के पश्चात आयतन में कमी होती है। इसलिए लाशातेलिये नियम के अनुसार कम ताप और अधिक दाब पर अमोनिया अधिक उत्पन्न होता है।

कम ताप पर अमोनिया का वेग बढ़ाने के लिए एक उत्प्रेरक का प्रयोग किया जाता है। इस अभिक्रिया का उत्प्रेरक की उपस्थिति में अनुकूलन ताप 450 डिग्री सेंटीग्रेड से 500 डिग्री सेंटीग्रेड तथा उच्च दाब वायुमंडल है क्योंकि अभिक्रिया उत्क्रमणीय है। इसलिए इस गैस को बराबर क्रिया क्षेत्र से हटाने के बाद अमोनिया गैस अधिक बनेगी।
अमोनिया बनाने की विधि
सुद्घ नाइट्रोजन तथा हाइड्रोजन को 1:3 अनुकूलन में मिलाकर 200 वायुमंडल दाब पर तप्त लोहे के बारीक चूर्ण यानी की उत्प्रेरक को, जिसमे मोलिब्डेनम यानी उत्प्रेरक वर्धक मिला होता है। इस विधि में 10 से 15% अमोनिया बनती है। शेष गैसों को फिर से उत्प्रेरक जिसे संघनित में प्रवाहित करके द्रवित कर लेते हैं। शेष गैसों को फिर से उत्प्रेरक कक्ष में प्रवाहित करते हैं। जिससे नाइट्रोजन व हाइड्रोजन के संयोजन द्वारा अमोनिया का लगातार उत्पादन होता रहता है।
अमोनिया के रासायनिक गुण
यह छारीय गैस है तथा लाल लिटमस को नीला कर देती है। यह अम्लों से क्रिया करके लवण बनाती है।
NH₃ + HCl → NH₄Cl (अमोनियम क्लोराइड)
NH₃ + H₂SO₄ → (NH₄)₂ SO₄ (अमोनियम सल्फेट)
अमोनिया का उपयोग
- प्रयोगशाला में अभिकर्मक के रूप में इसका प्रयोग होता है।
- बर्फ बनाने तथा कोल्ड स्टोरेज में प्रशीतक के रूप में क्योंकि वाष्पन की गुप्त ऊष्मा 327 कैलोरी ग्राम उच्च होती है।
अमोनिया से हानि- अगर अमोनिया वायु में ज्यादा मात्रा में फैल जाता है और उसे कोई व्यक्ति ज्यादा सूंघ लेता है या उसके अंदर प्रवेश करता है तो वह उसके लिए बहुत ही खतरनाक होता है जिससे उसकी मृत्यु भी हो सकती है।
अंतिम निष्कर्ष- आज मैंने आपको बताया कि अमोनिया क्या होता है और इसके उपयोग लाभ, हानि और यह कैसे बनता है इसके बारे में बताया है अगर आपको मेरी यह पोस्ट पसंद आती है तो इसे जरूर शेयर करें और आप 10th 12th से संबंधित जानकारी तुरंत पाना चाहते हैं तो हमारा टेलीग्राम चैनल ज्वाइन करे जी धन्यवाद।