हेलो, दोस्तों आज की इस पोस्ट के माध्यम से, मैं आपको अपरूप के बारे में जानकारी देने वाला हूँ, यदि आप जानकारी पाना चाहते हो तो पोस्ट को पूरा पढ़कर जानकारी प्राप्त कर सकते हो।
अपरूप किसे कहते हैं?
अपरूपता जब एक ही तत्व कई रूपों में मिलता है तो तत्व के इस गुण को अपरूपता (एलॉट्रोपी) कहते हैं और उसके विभिन्न रूपों को उस तत्व का अपरूप कहते हैं। जैसे कार्बन के विभिन्न अपरूप हीरा (डायमंड), ग्रेफाइट, कोयला (कोल), कोक, चारकोल या काष्ठकोयला, अस्थिकोयला (बोनब्लैक), काजल, कार्बन, ब्लैक, गैस कार्बन और पेट्रोलियम कोक, तथा चीनी कोयला इत्यादि हैं। कार्बन के अतिरिक्त आक्सीजन, गंधक, फॉस्फोरस आदि भी अपरूपों में पाए जाते हैं।
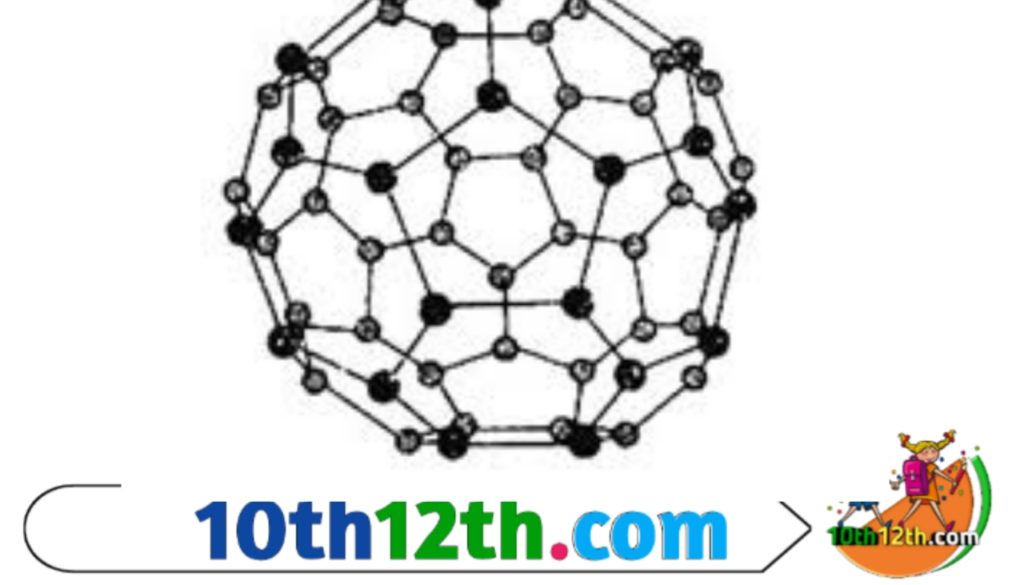
प्रकृति में कार्बन तत्व अनेक विभिन्न भौतिक गुणों के साथ विविध रूपों में पाया जाता है। यथा हीरा; ग्रेफाइट; फुलेरीन; आदि कार्बन के अपरूप (Allotrope) हैं।
हीरा तथा ग्रेफाइट दोनों ही कार्बन के परमाणुओं से बने हैं; परंतु दोनों में कार्बन के परमाणुओं के परस्पर आबंधन के तरीकों में अंतर होता है; जिसके कारण हीरे तथा ग्रेफाइट के गुणों में अंतर होता है।
हीरे में कार्बन के प्रत्येक परमाणु कार्बन के चार अन्य परमाणुओं के साथ आबंधित होता है; जिससे एक दृढ़ त्रिआयामी संरचना बनती है।
हीरा प्रकृति में पाया जानेवाला अबतक ज्ञात सबसे कठोर वस्तु है। हीरा विद्युत का कुचालक होता है।
कार्बन एक अधातु है। जबकि अन्य अधातु चमकदार नहीं होते हैं; हीरा अत्यधिक चमकदार होता है। हीरे में यह विशेष चमक उसके संरचना के कारण प्रकाश के परावर्तन के कारण होता है।
ग्रेफाइट में कार्बन के प्रत्येक परमाणु का आबंधन कार्बन के तीन अन्य परमाणुओं के साथ एक ही तल पर होता है जिससे षटकोणीय व्यूह मिलता है। ग्रेफाइट के इस संरचना में षटकोणीय तल एक दूसरे के ऊपर व्यवस्थित होते हैं।
अपरूप एक ही तत्व के विभिन्न संरचनात्मक रूप हैं और काफी अलग भौतिक गुणों और रासायनिक व्यवहार का प्रदर्शन कर सकते हैं। बहुरूपी रूपों के बीच परिवर्तन कुछ विशेष कारकों अर्थात दाब, प्रकाश व ताप के प्रभाव से शुरू होता है।
इसलिए, विशेष अपरूपों की स्थिरता विशेष परिस्थितियों पर निर्भर करती है। उदाहरण के लिए, काय केंद्रित घन संरचना (फेराइट) से लोहे का परिवर्तन कर फलक केंद्रित घन संरचना (ऑस्टेनाइट) मे करने के लिए 906 डिग्री सेल्सियस से ऊपर और टिन का परिवर्तन धात्विक टिन से अर्धचालक टिन मे करने के लिए उसे 13.2 डिग्री सेल्सियस से नीचे लाना पड़ता है। विभिन्न रासायनिक व्यवहार वाले अपरूपों का एक उदाहरण ओजोन (O3) है जो अपने अपरूप डाई आक्सीजन(O2) की तुलना में ज्यादा शक्तिशाली ऑक्सीकारक है।

