- आयनीकरण ऊर्जा क्या है?
- आयनीकरण ऊर्जा और बोहर का परमाणु मॉडल
- आवर्त सारणी में आयनीकरण ऊर्जा
आयनीकरण ऊर्जा सरल शब्दों में एक परमाणु या आयन से एक इलेक्ट्रॉन को हटाने में कठिनाई या एक परमाणु या आयन की एक इलेक्ट्रॉन को आत्मसमर्पण करने की प्रवृत्ति के रूप में वर्णित किया जा सकता है। इलेक्ट्रॉन का नुकसान आमतौर पर रासायनिक प्रजातियों की जमीनी अवस्था में होता है।
वैकल्पिक रूप से, हम यह भी कह सकते हैं कि आयनीकरण या आयनीकरण ऊर्जा उस शक्ति (आकर्षक बल) का माप है जिसके द्वारा एक स्थान पर एक इलेक्ट्रॉन धारण किया जाता है।
आयनीकरण ऊर्जा क्या है?
अधिक तकनीकी शब्दों में हम आयनीकरण ऊर्जा को न्यूनतम ऊर्जा के रूप में वर्णित कर सकते हैं जो एक गैसीय परमाणु या आयन में एक इलेक्ट्रॉन को नाभिक के प्रभाव से बाहर आने के लिए अवशोषित करना पड़ता है। इसे कभी-कभी आयनीकरण क्षमता के रूप में भी जाना जाता है और आमतौर पर एक एंडोथर्मिक प्रक्रिया होती है।
हम आगे जो निष्कर्ष निकाल सकते हैं वह यह है कि आयनीकरण ऊर्जा हमें रासायनिक यौगिकों की प्रतिक्रियाशीलता का एक विचार देती है। इसका उपयोग रासायनिक बंधों की ताकत को निर्धारित करने के लिए भी किया जा सकता है। इसे या तो इलेक्ट्रॉनवोल्ट या kJ/mol की इकाइयों में मापा जाता है।
अणुओं के आयनीकरण के आधार पर जो अक्सर आणविक ज्यामिति में परिवर्तन की ओर जाता है, आयनीकरण ऊर्जा या तो रुद्धोष्म आयनीकरण ऊर्जा या ऊर्ध्वाधर आयनीकरण ऊर्जा हो सकती है।
आयनीकरण ऊर्जा और बोहर का परमाणु मॉडल
परमाणु के बोहर मॉडल का उपयोग करके परमाणु आयनीकरण ऊर्जा की भविष्यवाणी की जा सकती है। उनका मॉडल इलेक्ट्रॉन के प्रोटॉन और न्यूट्रॉन वाले नाभिक के चारों ओर जाने के लिए कई रास्तों की उपस्थिति की भविष्यवाणी करता है। प्रत्येक पथ या कक्षा नाभिक से एक निश्चित दूरी पर होती है।
प्रत्येक कक्षा निश्चित ऊर्जा का भी प्रतिनिधित्व करती है। इलेक्ट्रॉन एक कण है और इसमें कक्षा की ऊर्जा मौजूद होगी। एक कण ऊर्जा को अवशोषित कर सकता है और उच्च ऊर्जा की अगली उच्च कक्षाओं में कूद सकता है। यदि अधिक ऊर्जा उपलब्ध और अवशोषित हो जाती है, तो इलेक्ट्रॉन नाभिक के आकर्षण बल से बाहर आ जाएगा, जिसका अर्थ है परमाणु से बाहर।
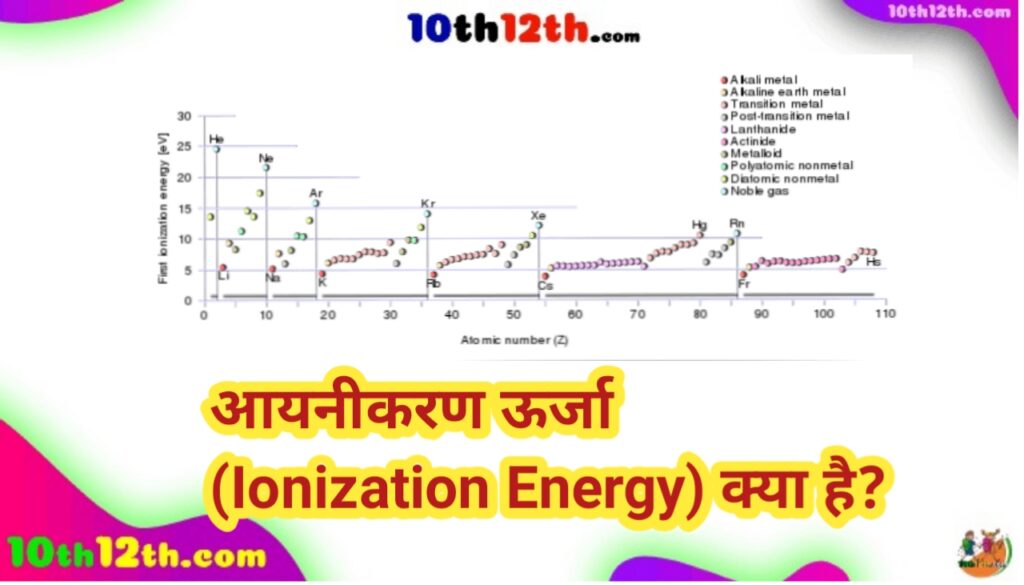
आवर्त सारणी में आयनीकरण ऊर्जा
एक इलेक्ट्रॉन की आयनीकरण ऊर्जा परमाणु की परमाणु संख्या के साथ बढ़ती है और उच्च ऊर्जा वाले कक्षकों के लिए घटती है। यदि हम आवर्त सारणी को देखें और तत्वों के आर-पार बाएँ से दाएँ जाएँ, तो परमाणु त्रिज्या घटने के कारण आयनन ऊर्जा बढ़ती है।
जबकि ऊपर से नीचे जाने पर आयनन ऊर्जा कम हो जाती है। यह मुख्य रूप से तत्वों में अधिक इलेक्ट्रॉन कोशों की उपस्थिति के कारण होता है क्योंकि हम समूह में नीचे जाते हैं। इसके अतिरिक्त, इलेक्ट्रॉनों को नाभिक की आकर्षक शक्तियों से अधिक दूरी पर रखा जाता है।

