हेलो, दोस्तों आज की इस पोस्ट के माध्यम से, मैं आपको अणुसंख्य गुणधर्म के बारे में जानकारी देने वाला हूँ, यदि आप जानकारी पाना चाहते हो तो पोस्ट को पूरा पढ़कर जानकारी प्राप्त कर सकते हो।
अणुसंख्य गुणधर्म के बारे में
विलयनों के कुछ गुण उनके निश्चित आयतन (fixed volume) में उपस्थित विलेय के कणों (अणुओं, परमाणुओ या आयनों) की संख्या पर निर्भर करते हैं। इन्हें अणुसंख्य गुणधर्म (colligative properties) कहते हैं। ये गुण विलेय की रासायनिक संरचना (chemical composition) या संघठन पर निर्भर नहीं करते हैं, बल्कि विलायक (solvent) की निश्चित मात्रा में उपस्थित इनकी संख्या पर निर्भर करते हैं। ऐसे कुछ गुण निम्नलिखित हैं।
अणुसंख्य गुणधर्म के प्रकार
अणुसंख्य गुणधर्म निम्न चार प्रकार के होते हैं-
- वाष्प दाब का आपेक्षित अवनमन (relative depression of steam pressure)
- क्वथनांक का उन्नयन (boiling Point)
- हिमांक का अवनमन (freezing point)
- विलयन का परासरण दाब (osmotic pressure of the solution)
वाष्प दाब का आपेक्षित अवनमन
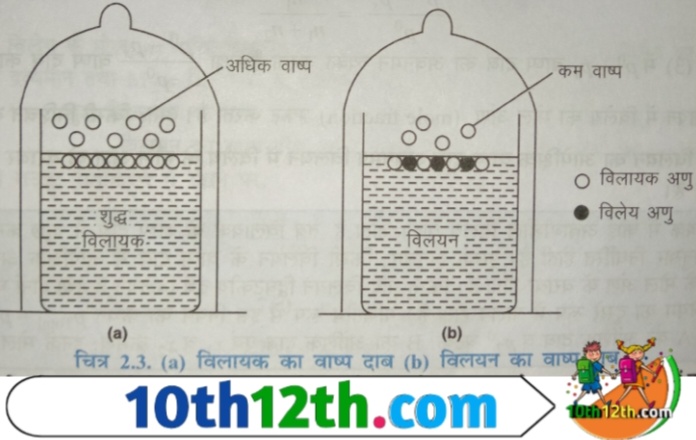
यदि एक सुद्ध विलायक का वाष्प दाब (vapor pressure) ज्ञात करें और उसी विलायक में किसी अवाष्पशील यौगिक (non-volatile compounds) मतलब ठोस को विलेय करके उस विलयन का वाष्प दाब ज्ञात करें तो पाया जाता है कि एक विलयन (solution) का वाष्प दाब शुद्ध विलायक वाष्प दाब से सदैव कम होता है।
अतः किसी अवाष्पशील विलेय पदार्थ के कारण विलयन के वाष्प में जो कमी अथवा अवनमन होता है, उसे वाष्प दाब का अवनमन (lowering of vapour pressure) कहते हैं। चूंकि विलेय पदार्थ अवाष्पशील है, इसलिए विलयन के ऊपर जो वाष्प (vapor) होती है वह केवल शुद्ध विलायक की होती है। विलयन में सुद्ध विलायक (pure solvent) की तुलना में विलायक के अणुओं (particle) की संख्या कम हो जाती है, अतः वाष्पीकृत अणुओं (vaporized molecules) की संख्या में भी कमी आ जाती है। अतः इससे वाष्प में भी कमी आ जाती है।
क्वथनांक का उन्नयन
प्रत्येक द्रव एक निश्चित ताप पर उबलता है जिससे उसका क्वथनांक (boiling point) कहते हैं। इस ताप पर द्रव का वाष्प दाब वायुमंडलीय दाब के बराबर हो जाता है। जैसा कि सुद्ध विलायक का कमरे के ताप (T₁) पर निश्चित आप निश्चित वाष्प दाब (P₁) होता है। जब इसे गर्म किया जाता है तब इसका वाष्प दाब धीरे-धीरे बढ़ने लगता है और T₂ ताप पर जब इसका वाष्प दाब वायुमंडलीय दाब (atmospheric pressure) के बराबर हो जाता है, तब यह उबलने लगता है।
आप देख चुके हो कि विलयन (solution) का वाष्प दाब शुद्ध विलायक के वाष्प दाब से कम होता है, इसलिए जब किसी द्रव में कोई अवाष्पशील पदार्थ (non-volatile substances) घोल देते हैं तब कक्ष T₁ पर इसका वाष्प दाब P₁ से घटकर P₂ रह जाता है। अब इस विलयन को गर्म करने पर T₂ ताप पर इसका वाष्प दाब P₁ के बराबर होता है और T₃ ताप पर इसका वाष्प दाब (vapor pressure) वायुमंडलीय के बराबर होता है।
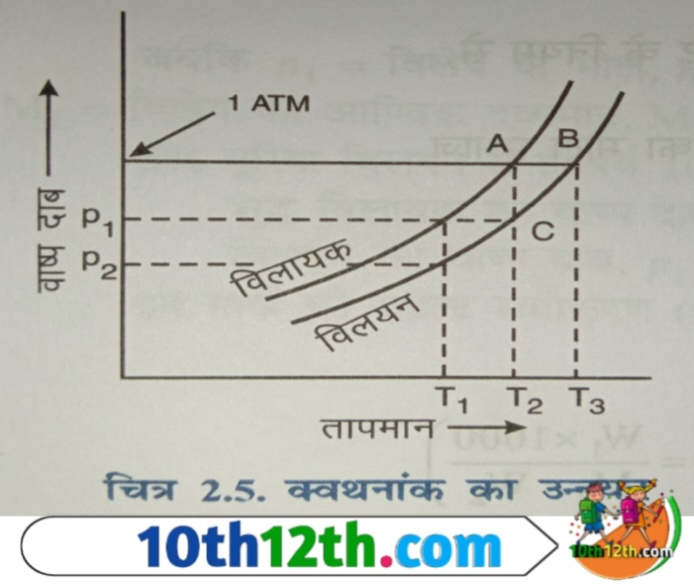
अतः अब विलायक का क्वथनांक T₂ से बढ़कर T₃ हो जाता है अर्थात सुद्ध विलायक की अपेक्षा विलयन उच्च ताप पर उबलता है। विलेय को विलायक में घोलने से उसके क्वथनांक में होने वाली वृद्धि को क्वथनांक का उन्नयन (elevation in boiling point) कहते हैं। इसे डेल्टा ΔTb से प्रदर्शित करते हैं।
हिमांक का अवनमन
जब किसी विलायक को ठंडा किया जाता है तब वह किसी ताप पर जम जाता है। इस ताप को विलायक का हिमांक (freezing point) कहते हैं। इस ताप पर पदार्थ की ठोस और द्रव अवस्थाओं का वाष्प दाब (vapor pressure) समान होता है तथा पदार्थ की ठोस और द्रव अवस्थाए में एक दूसरे के साथ साम्य (resemblance) में रहती हैं। हम जानते हैं कि जब किसी विलायक में अवाष्पशील पदार्थ (non-volatile substances) मिलाया जाता है तब उसका वाष्प दाब गिर जाता है, इसलिए यह आशा की जाती है कि विलयन का हिमांक (freezing point) शुद्ध विलायक के हिमांक की अपेक्षा कम होता है। इसे हिमांक में अवनमन (Freezing point) कहते हैं।
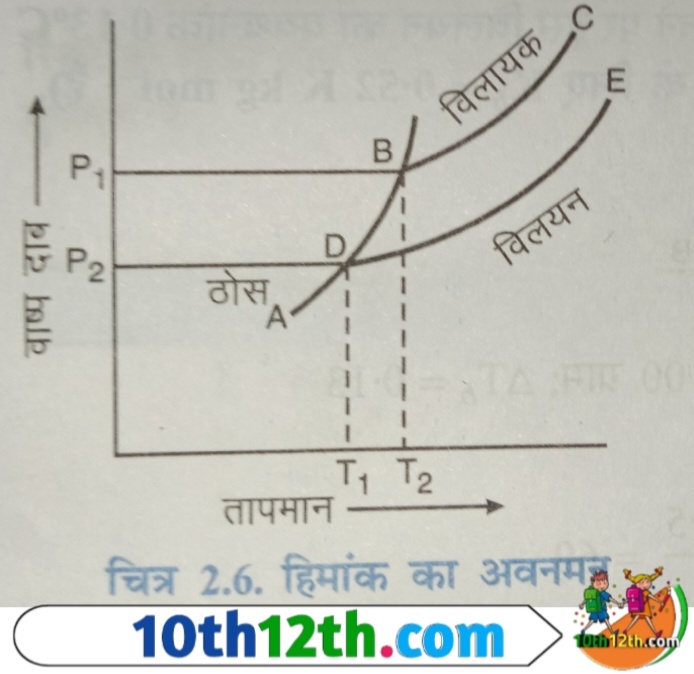
इसे ग्राफीय रूप से चित्र में दर्शाया गया है। इस चित्र में वक्र BC और DE क्रमशः विलायक और विलयन के वाष्प दाब प्रदर्शित करते हैं। वक्र AB विभिन्न तापो पर ठोस विलायक (solid solvent) के वाष्प दाब को प्रदर्शित करता है। B बिंदु पर द्रव और ठोस विलायक (solvent) के वाष्प दाब परस्पर मिलते हैं। अतः ये अणुसंख्य गुणधर्म के अन्तर्गत आता है। यह बिंदु सुद्ध विलायक (pure solvent) के हिमांक को प्रदर्शित करता है। अतः ताप T₂ विलायक का हिमांक है। इसी प्रकार ताप T₁ विलयन का हिमांक है। इन दो तापो का अंतर (T₂-T₁ ) = ΔTf हिमांक का अवनमन कहलाता है।
विलयन का परासरण दाब
जब किसी विलयन (solution) को अर्द्ध-पारगम्य झिल्ली (semi permeable membrane) के द्वारा शुद्ध विलायक से अलग रखा जाता है, तब विलायक के कण झिल्ली (membrane) में से होकर विलयन में बहने लगते हैं और तब तक बहते हैं जब तक कि झिल्ली के दोनों ओर विलयन का सांद्रण बराबर नहीं हो जाता है। इस क्रिया को परासरण (osmosis) कहते हैं।
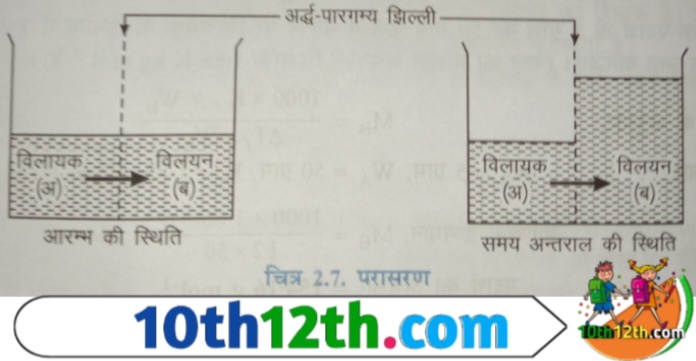
विलायक के कणों का यह प्रवाह तब भी होता है जब कम सांद्र विलयन को अधिक सांद्र विलयन (concentrated solution) से अर्द्ध-पारगम्य झिल्ली (Semi-permeable membrane) के द्वारा पृथक रखा जाता है। इस दशा में विलायक के अणु (solvent molecules) कम सांद्र विलयन से अधिक सांद्र विलयन में प्रवेश करते हैं। अतः वह प्रक्रिया जिसमें शुद्ध विलायक के कण (pure solvent particles) कम सांद्र विलयन में से उच्च सांद्र विलयन में अर्द्ध-पारगम्य झिल्ली में से होते हुए प्रवाहित होते हैं, परासरण (osmosis) अथवा परासरणी बहाव कहलाती है।

