क्रिस्टलीय ठोस (Crystalline solid): पदार्थों के कणों के मध्य बंधन बल (binding force) इस तथ्य पर निर्भर करते हैं कि रचक घटको की प्रकृति क्या है? बंधन बलों के आधार पर क्रिस्टलीय ठोस (Crystalline solid) को चार भागों में वर्गीकृत किया जाता है।
आयनिक ठोस
ये ठोस वे ठोस पदार्थ है। जिनके क्रिस्टलो की संरचनात्मक इकाई आयन (धनायन व ऋणायन) होते हैं। उदाहरण- NaCl, CsCl, ZnCl₂ आदि। Nacl में संरचनात्मक इकाई Na⁺ व Cl⁻ आयन होते हैं।
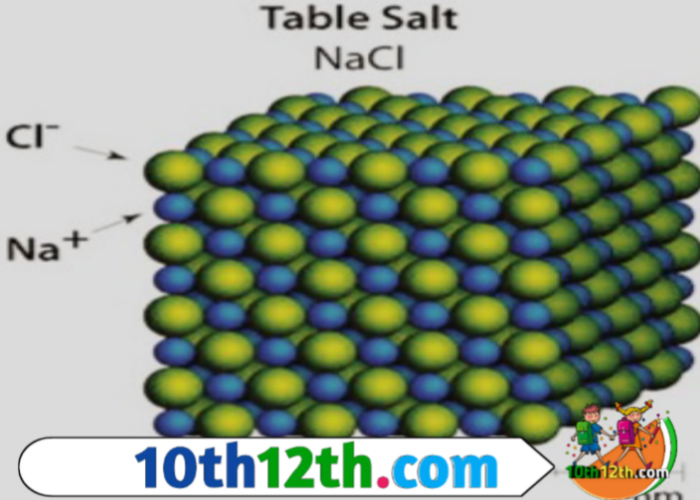
आयनिक ठोस के लक्षण
- यह ठोस (hard) धन (+) व ऋण (-) आवेश (charge) वाले आयनो (Anion) से बने होते हैं।
- विपरीत आवेश वाले आयनो के मध्य कूलाम (coulomb) आकर्षण बल होता है। अतः इन ठोसो में बंधन बल कूलाम आकर्षण बल होता है।
- ये ठोस कठोर (hard) व भंगुर (brittle) प्रकृति के रखते हैं।
- ये ठोस सूत्र इकाइयों (formula units) के मध्य भी प्रबल (strong) विद्युत आकर्षण बल रखते हैं जिसके कारण ये उच्च गलनांक और उच्च क्वथनांक रखते हैं।
- यह उच्च (high) वाष्पन ऊष्मा (heat of vaporisation) रखने के कारण अवाष्पशील (non-volatile) होते हैं।
- ये ध्रुवीय (polar) विलायको (polar solvent) में विलय होते हैं।
- ये ठोस अवस्था में विद्युत के कुचालक (bad conductor) व विलयन या गलित (fused) अवस्था में विद्युत के चालक होते हैं।
आण्विक ठोस
ये ठोस वे ठोस पदार्थ होते हैं जिनके क्रिस्टलो की संरचनात्मक इकाई अणु होते हैं। उदाहरण- आयोडीन, ठोस मीथेन, बर्फ आदि आण्विक ठोसो में अणुओं के मध्य वाण्डर वाल (van der waal) बल पाए जाते हैं। ध्रुवीय आणविक ठोस, जैसे- ठोस कार्बन मोनोऑक्साइड (CO) द्विधुव्र-बंधन बल रखते हैं।

अध्रुवीय आणविक ठोस जैसे- ठोस ऑक्सीजन (O₂) लण्डन बंधन बल रखते हैं। इसके अतिरिक्त कुछ आणविक ठोस हाइड्रोजन बंधन बल भी रखते हैं, जैसे- बर्फ (H₂O), ठोस अमोनिया (NH₃)। अतः ये क्रिस्टलीय ठोस के अन्तर्गत आते हैं।
आण्विक ठोस के लक्षण
- ये ठोस अणुओं द्वारा बने होते हैं।
- इन ठोसो में अंतकरण (Transfer) बंधन बल (Binding force) वाण्डर वाल बल होता है।
- ये ठोस मुलायम (soft) होते हैं।
- रचक घटकों (Stirrer component) के मध्य दुर्बल (weak) वाण्डर वाल बल के कारण ये ठोस निम्न (low) गलनांक व निम्न क्वथनांक (boil point) रखते हैं।
- ये निम्न वाष्पन ऊष्मा (Low heat) रखने के कारण सामान्यतः वाष्पशील होते हैं।
- ध्रुवीय व अध्रुवीय विलायको में विलेय होते हैं।
- ये ऊष्मा व विद्युत के कुचालक होते हैं।
सहसंयोजी ठोस
ये ठोस वे ठोस पदार्थ होते हैं जिनकी संरचनात्मक इकाई परमाणु होते हैं। उदाहरण- हीरा (diamond), ग्रेफाइट, सिलिका आदि। इन ठोसो में परमाणुओं के मध्य सहसंयोजक बंध पाए जाते हैं। सहसंयोजक बंधो के द्वारा इस प्रकार के ठोस विशाल (giant) अन्तरबन्धीय (interlocking) संरचना रखते हैं। अतः ये नेटवर्क ठोस (network solids) भी कहलाते हैं।

सहसंयोजी ठोस के लक्षण
- ये ठोस परमाणुओं द्वारा बने होते है।
- इन ठोसो में सहसंयोजक अंतकरण बन्धन होता है।
- ये अति कठोर व भंगुर होते हैं।
- नेटवर्क के कारण ये अत्यधिक उच्च गलनांक (High melting point) व क्वथनांक (boil point) रखते हैं।
- ये उच्च वाष्पन ऊष्मा (High evaporative heat) रखने के कारण अवाष्पशील होते है।
- ये ऊष्मा व विद्युत के कुचालक होते हैं।
धात्विक ठोस
ये ठोस वे ठोस पदार्थ होते हैं जिनकी संरचनात्मक इकाई धातु परमाणु (metal atoms) होते हैं। उदाहरण- कॉपर, रजत, निकिल आदि। इन ठोसो के परमाणुओं के मध्य धात्विक बन्ध पाए जाते हैं।
धातु परमाणु संयोजकता इलेक्ट्रॉनों के समुद्र में निश्चित ज्यामिति रखते हैं। संयोजकता इलेक्ट्रॉन त्यागने के पश्चात परमाणु का शेष भाग धनावेशित हो जाता है। धनावेशित भाग व इलेक्ट्रॉनों के मध्य आकर्षण बल धात्विक बन्ध (Metallic bond) कहलाता है। अतः यह क्रिस्टलीय ठोस के अन्तर्गत आते हैं।
धात्विक ठोस के लक्षण
- ये ठोस धातु परमाणुओं द्वारा बने होते हैं।
- इन ठोसो में अंतकरण बन्धन (Transfer fastening) धात्विक बन्ध (Metallic bond) होता है।
- ये अति मुलायम (soft) से अति कठोर (hard) होते हैं। जैसे- सोडियम (Na) अति मुलायम व ओसि्मयम अति कठोर (hard) है।
- निम्न से उच्च गलनांक व क्वथनांक रखते हैं।
- ये निम्न से उच्च वाष्पन ऊष्मा रखते हैं।
- यह ऊष्मा व विद्युत के सुचालक होते हैं।
- ये तन्य (ductile) व आघातवर्धनीय (malleable) होते हैं।
क्रिस्टलय ठोस के प्रकार व भौतिक गुण (physical properties) और उनके उदाहरण
| क्रिस्टल के प्रकार | रचक घटक (Stirrer component) | प्रमुख गुण (leading strand) | भौतिक गुण (physical properties) | उदाहरण |
| (a) आयनिक | धनात्मक तथा ऋणात्मक आयन | स्थिर विद्युत बन्ध या कूलाम बल | कठोर, भंगुर, उच्च गलनांक, उच्च गलन ऊष्मा, ठोस अवस्था में कुचालक, प्रगलित अवस्था या विलयन में सुचालक | NaCl, NaF, AgCl, LiF |
| (b) सहसंयोजक | परमाणु | सहसंयोजी बन्ध | कठोर, मध्यम उच्च गलनांक(Medium high melting point), उच्च गलन ऊष्मा, ऊष्मा व विद्युत के कुचालक (bad conductor) | स्फटिक, हीरा, ग्रेफाइट |
| (c) आण्विक | अणु | दुर्बल वाण्डर वाले आकर्षण बल (द्विधुव्र-द्विधुव्र लण्डन बल) कुछ अणुओं में हाइड्रोजन बन्ध भी | मुलायम, निम्न गलनांक, विद्युत व ऊष्मीय कुचालक, निम्न गलन ऊष्मा, वाष्पीय प्रकृति | बर्फ, आयोडीन, सल्फर, फॉस्फोरस, मोम तथा ठोस CO₂ |
| (d) धात्विक | धातु परमाणु (इलेक्ट्रॉन समुद्र में धनायन) | धात्विक आबन्ध | मुलायम और कठोर (soft and hard) दोनों, ऊष्मा व विद्युत के सुचालक(conductor), तन्य, आघात- वर्धनिय, धात्विक चमक(Metallic luster), सामान्य से उच्च गलन ऊष्मा, निम्न से उच्च गलनांक। | धातुएं (Al, Fe, Cu, Na, Li, Mo, W, Ni, Co) |

