हेलो, दोस्तों आज की इस पोस्ट के माध्यम से, मैं आपको विद्युत रसायन के बारे में जानकारी देने वाला हूँ, यदि आप जानकारी पाना चाहते हो तो पोस्ट को पूरा पढ़कर जानकारी प्राप्त कर सकते हो।
विद्युत रसायन किसे कहते है?
विद्युत रसायन किसे कहते है और फैराडे के नियम व उपयोग, रसायन विज्ञान की वह शाखा जिसके अंतर्गत रसायनिक ऊर्जा तथा विद्युत ऊर्जा का एक दूसरे में परिवर्तन का अध्ययन किया जाता है विद्युत रसायन कहलाता है।
तो आइए जान लेते हैं विद्युत रसायन से संबंधित कुछ ऐसी परिभाषिक शब्द जो आपको चैप्टर को समझने में आसानी देंगे।
विद्युत अपघटय
वह पदार्थ जो विलयन या गलित अवस्था में आयन देते हैं, विद्युत अपघटय कहलाते है। यह वे चालक होते हैं जिनमें विद्युत धारा प्रवाहित करने पर कोई न कोई रासायनिक परिवर्तन हो जाता है। ये विद्युत प्रवाह के कारण अपघटित हो जाते हैं।
इन चालको को इसी कारण से विद्युत अपघटय या विद्युत अपघटनी चालक कहते हैं इस प्रकार के चालकों में विद्युत धारा का प्रभाव इलेक्ट्रॉनों द्वारा न होकर धन और ऋण आयनों के प्रवाह के कारण होता है जैसे ही विद्युत धारा का प्रवाह रुक जाता है वैसे ही विद्युत अपघटय का अपघटन रुक जाता है उदाहरण के लिए अम्ल, क्षार और लवण का विलयन।
विद्युत अपघटन
कुछ ऐसे भी रासायनिक पदार्थ है जो न तो पिघलने की अवस्था में है न ही जलीय विलयन में से हैं विद्युत धारा प्रवाहित कर सकते हैं उन्हें विद्युत अपघटन कहते हैं जैसे उदाहरण के लिए एल्कोहल, ईथर, ग्लूकोज आदि।
फैराडे का विद्युत अपघटन नियम
सन् 1832 में माइकल फैराडे ने कई प्रयोगों के आधार पर दो फैराडे के नियम दिए जिन्हें हम फैराडे के विद्युत अपघटन नियम कहते हैं।
फैराडे का प्रथम नियम
इलेक्ट्रोड पर मुक्त होने वाले पदार्थ की मात्रा विलयन में प्रवाहित विद्युत धारा की समानुपाती होती है।
फैराडे का द्वितीय नियम
यदि विद्युत के समान मात्रा को भिन्न-भिन्न विद्युत अपघटयो में से प्रवाहित किया जाए तो इलेक्ट्रॉनों पर एकत्रित भिन्न-भिन्न पदार्थों की मात्राएं उनके तुल्यांकी भारो के समानुपाती होती है।
फैराडे के नियमों का उपयोग
- इलेक्ट्रोडो पर विद्युत अपघटन द्वारा मुक्त होने वाले पदार्थों की मात्रा ज्ञात करने में।
- विद्युत रसायन तुल्यांक की गणना करने में।
- किसी तत्व या मूलक का तुल्यांकी भार ज्ञात करने में किया जाता है।
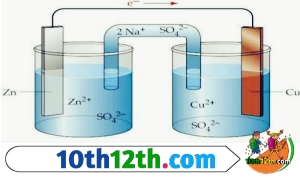
विद्युत रासायनिक सेल
रेडॉक्स अभिक्रियाओ में ऑक्सीकारको और अपचायको के मध्य इलेक्ट्रॉनों का स्थानांतरण अप्रत्यक्ष रूप से जैसे की तार जोड़कर करने पर रासायनिक ऊर्जा का परिवर्तन विद्युत ऊर्जा में होने लगता है। इस प्रकार की गई व्यवस्था को विद्युत रसायन सेल कहते हैं। इसे हम इसे हम गैल्वेनिक सेल या वोल्टीय सेल कहते हैं।

