Table of Contents
▼
हेलो, दोस्तों आज की इस पोस्ट के माध्यम से, मैं आपको हेनरी नियम के बारे में जानकारी देने वाला हूँ, यदि आप जानकारी पाना चाहते हो तो पोस्ट को पूरा पढ़कर जानकारी प्राप्त कर सकते हो।
हेनरी नियम के बारे में
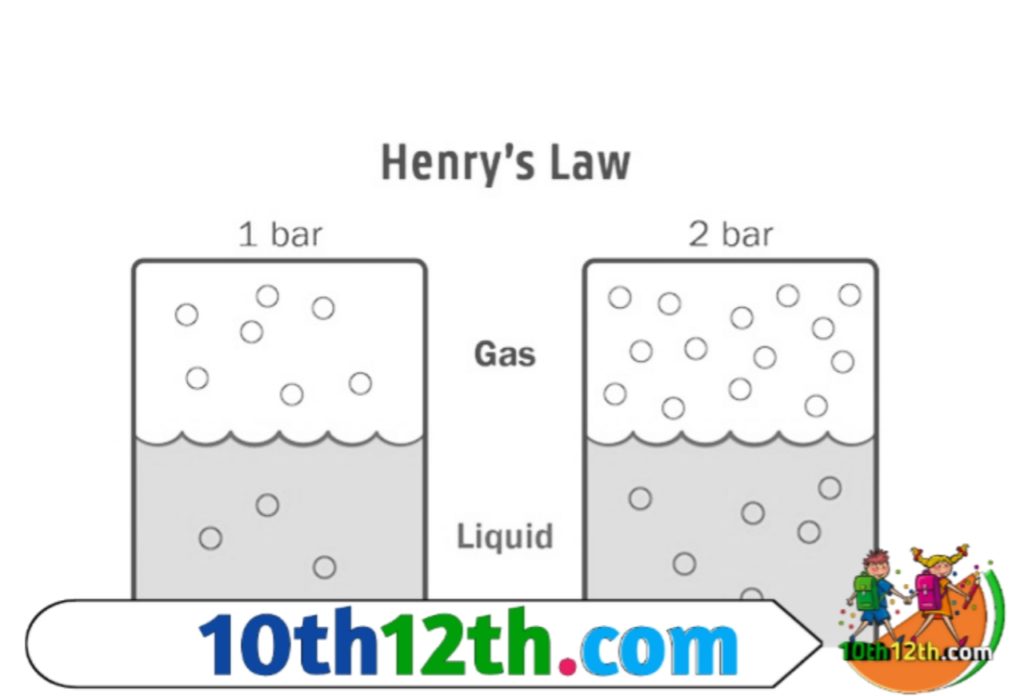
हेनरी (henri) ने गैस की विलायक (solvent) में विलेयता तथा दाब के मध्य मात्रात्मक संबंध का अध्ययन किया और एक नियम (law) दिया जिसे हेनरी का नियम (henry's law) कहते हैं। इसके अनुसार स्थिर ताप (constant temperature) पर किसी गैस की द्रव में विलेयता (solubility) गैस के दाब के समानुपाती होता है।
हेनरी नियम के अनुप्रयोग
- सोडा जल एवं शीतल पेयों में CO₂ की विलेयता बढ़ाने के लिए बोतल को अधिक दाब पर बंद किया जाता है।
- गहरे समुद्र में श्वास लेने के लिए गोताखोर (diver) ऑक्सीजन प्राप्त करने के लिये संपीड़ित वायु (compressed air) पर निर्भर करते हैं। अधिक वायुमंडलीय दाब (atmospheric pressure) के कारण श्वास के साथ ली गई वायुमंडलीय गैसों N₂, O₂ आदि की रक्त में विलेयता अधिक हो जाती है। ऑक्सीजन तो शरीर की मुख्य क्रिया है। किंतु नाइट्रोजन रुधिर में विलेय रहती है। जब गोताखोर सतह की ओर आते हैं, तब भारी दाब धीरे-धीरे कम होने लगता है। इस कारण घूली हुई N₂ गैस बाहर निकलने लगती है, इससे रक्त में N₂ के बुलबुले बन जाते हैं। यह बुलबुले तंत्रिका स्पंदनो (nerve impulses) को प्रभावित कर देते हैं और एक बीमारी उत्पन्न कर देते हैं जिसे बेंड्स (bends) कहते है। यह अत्यधिक पीड़ादायक और जानलेवा होती है।
- गोताखोर द्वारा सांस लेने के लिए उपयोग किये जाने वाले टैंको में हीलियम (He) मिलाकर तनु की गयी वायु (attenuated air) का उपयोग किया जाता है।
- सामान्यतः 2% O₂ और 98% हीलियम का मिश्रण प्रयुक्त किया जाता है जो O₂ का उतना ही आंशिक दाब देता है जितना कि सामान्य वायु में एक वायुमंडलीय दाब पर ऑक्सीजन देती है।
- अधिक ऊंचाई वाले स्थानों पर ऑक्सीजन का आंशिक दाब सतही स्थानों से कम होता है। अतः इन स्थानों पर रहने वाले लोगों एवं पर्वतारोहियों (climber) के रक्त एवं ऊतकों में ऑक्सीजन की सांद्रता (concentrations) निम्न हो जाती है। इसके कारण पर्वतारोहि (climber) कमजोरी महसूस करते हैं और स्पष्ट रूप से सोच नहीं पाते हैं।
हेनरी नियम की सीमाएं
- यह नियम तनु विलयनो (week solution) के लिए लागू होता है, यदि गैस, द्रव में अत्यधिक विलेय (soluble) है तो इस नियम का पूर्ण पालन नहीं होता है।
- दाब निम्न (pressure low) और ताप उच्च (heat high) होना चाहिए अर्थात गैस को आदर्श गैस (ideal gas) के समान व्यवहार प्रदर्शित करना चाहिए।
- गैस को विलायक के साथ क्रिया करके कोई यौगिक (compound) नहीं बनाना चाहिए तथा विलायक के साथ उसका संगुणन (Computation) या वियोजक नहीं होना चाहिए। उदाहरण के लिए यह नियम (law) अमोनिया का जल में विलीनीकरण की प्रक्रिया में लागू नहीं होता है, क्योंकि यह जल के साथ यौगिक बना लेता है जिसका आगे वियोजन भी हो जाता है। NH₃ (g) + H₂O → NH₄OH (aq) NH₄OH (aq) = NH₄⁺ (aq) + OH⁻ (aq) इस प्रकार HCl गैस का जल में विलीनीकरण पर भी यह नियम लागू नहीं होता है क्योंकि विलीनीकरण के बाद वियोजन होता है। HCl (g) + aq → HCl (aq) HCl (aq) → H⁺ (aq) + Cl⁻ (aq)
विभिन्न गैसो के हेनरी स्थिरांक
| गैस | ताप/K | KH (atm⁻¹) | KH (bar⁻¹) |
| CO₂ | 273K | 1.4×10⁻³ | 1.3×10⁻³ |
| 298K | 6.1×10⁻⁵ | 6.02×10⁻⁴ | |
| N₂ | 273K | 1.9×10⁻⁵ | 1.87×10⁻⁵ |
| 298K | 1.2×10⁻⁵ | 1.18×10⁻⁵ | |
| O₂ | 273K | 4.5×10⁻⁵ | 4.44×10⁻⁵ |
| 298K | 2.3×10⁻⁵ | 2.27×10⁻⁵ | |
| He | 273K | 6.8×10⁻⁶ | 6.71×10⁻⁶ |

