हेलो, दोस्तों आज की इस पोस्ट के माध्यम से, मैं आपको विलेयता के बारे में जानकारी देने वाला हूँ, यदि आप जानकारी पाना चाहते हो तो पोस्ट को पूरा पढ़कर जानकारी प्राप्त कर सकते हो।
विलेयता क्या है? | vileyta kya hai?
किसी पदार्थ की वह अधिकतम मात्रा जो निश्चित ताप पर विलायक (solvent) की एक निश्चित मात्रा में घुली होती है, पदार्थ की विलेयता (solubility) कहलाती है। इसका मान विलेय (soluble) एवं विलायक की प्रकृति के आधार पर मुख्यतया ताप (heat) व दाब (pressure) पर निर्भर करता है। इन कारकों (factors) के प्रभाव का अध्ययन गैस (gas) अथवा ठोस की द्रव विलेयता (liquid solubility) पर किया गया है।
विलेयता को प्रभावित करने वाले कारक
अधिकांश गैसे (gas) जल में घुलनशील होती है। इनकी यह घुलनशीलता (solubility) भिन्न-भिन्न गैसों के लिए अलग-अलग होती है। ऑक्सीजन (O) जल में बहुत कम मात्रा में घुलती है। ऑक्सीजन (O) की यह मात्रा जलीय जीवन को श्वसन आदि के द्वारा जीवित रखती है। इसके विपरीत हाइड्रोजन क्लोराइड (HCl), अमोनिया (NH₃) आदि गैसे जल में अत्यधिक घुलनशील होती है। कुछ गैसे एथिल एल्कोहाल (C₂H₅OH), बेंजीन (C₆H₆) आदि विलायकों में घुलनशील होती है।
किसी गैस का घन सेंटीमीटर (c.c.) में STP पर परिवर्तन वह आयतन जो दिये हुए ताप एवं 1 वायुमंडलीय दाब पर विलायक के घन सेंटीमीटर (c.c.) में घूलकर संतृप्त विलयन बनता है, गैस की विलेयता कहलाता है। गैस की सांद्रता को व्यक्त करने की यह विधि अवशोषण गुणांक (absorption coefficient) कहलाती है। इसे α से व्यक्त किया जाता है।
किसी दिये हुए ताप पर गैस की विलेयता को मोलरता (molarity) के रूप में (संतृप्त विलयन (saturated solution) बनाने के लिए 1 लीटर विलायक में आवश्यक गैस के मोलों (gas moles) की संख्या) अथवा गैस के मोल अंश (mole fraction, χₐ ) के रूप में भी व्यक्त किया जा सकता है।
गैस तथा द्रव की प्रकृति
शीघ्र द्रवित होने वाली या विलायक के साथ क्रिया करने वाली या ध्रुवीय गैसे, जैसे- HCI, NH₃, CO₂ अत्यधिक घुलनशील होती है। इसके विपरीत विलायक के साथ क्रिया न करने वाली या कठिनाई से द्रवित होने वाली या अध्रुवीय गैसे, जैसे- O₂, N₂ आदि की विलेयता कम होती है।
दूसरी ओर O₂, N₂ और CO₂ ताप और दाब की समान परिस्थितियों में एथिल एल्कोहाल में जल की तुलना में अधिक घुलनशील होती है जबकि H₂S और NH₃ जल की तुलना में एथिल एल्कोहाल (C₂H₅OH) में कम घुलनशील होती है।
किसी गैस की किसी विलायक (solvent) में अधिक घुलनशीलता का कारण उसका विलायक के साथ रासायनिक समानता (chemical similarity) का होना होता है।
20ºC पर कुछ गैसों के जल में अवशोषण गुणांक (ml में) |
| गैस | अवशोषण गुणांक |
| He | 0.009 |
| N₂ | 0.015 |
| H₂ | 0.017 |
| O₂ | 0.028 |
| CO₂ | 0.88 |
| H₂S | 2.62 |
| HCl | 442 |
| NH₃ | 710 |
ताप का प्रभाव
गैसों की द्रवों में विलेयता (solubility) ताप की वृद्धि पर कम हो जाती है। उदाहरण के लिए, जब जल को गर्म किया जाता है तो घुली हुई गैस बुलबुलों (bubbles) के रूप में निकल जाती है।
किसी गैस का विलायक में विलीनीकरण (dissolution) एक ऊष्माक्षेपी (exothermic) अभिक्रिया है अर्थात घूलने की प्रक्रिया में ऊष्मा उत्सर्जित है। गैस + विलायक = विलयन + ऊष्मा |
इसका कारण घुलने पर गैस के आयतन (gas volume) का संकुचित होना है। उपयुक्त समीकरण से ले-शातेलिए के नियम के अनुसार स्पष्ट है कि जब ताप में वृद्धि होगी तब साम्य पश्च दिशा (equidistant direction) की ओर विस्थापित होगा अर्थात विलेयता घट जाएगी।
अशुद्धियों का प्रभाव
घुली हुई अशुद्धियां भी गैसों की विलेयता को प्रभावित करती है। जैसे- शुद्ध जल की तुलना में पौटेशियम क्लोराइड (KCl) या सोडियम सल्फेट (Na₂SO₄) युक्त विलयन CO₂ में की विलेयता कम होती है। इसका कारण द्रव की अंतर-आणविक रिक्तियों का ठोस के अणुओं द्वारा (molecules of solids) घिर जाना है। इस प्रकार सोडा वाटर की बोतल में थोड़ा-सा नमक (salt) डालने पर झाग बोतल से बाहर निकलने लगते हैं। इससे सिद्ध होता है कि अशुद्धि (inaccuracy) के कारण गैस की विलेयता कम हो जाती है।
दाब का प्रभाव
गैसों की द्रवो (liquids of gases) में विलेयता दाब (solubility pressure) द्वारा बहुत अधिक प्रभावित होती है। दाब बढ़ने पर गैसों की विलेयता (solubility of gases) बढ़ती जाती है। इसे निम्न आधार पर समझा जा सकता है। माना गैसों के विलयन का एक निकाय p दाब व T ताप (heat) पर उपस्थित है जिसका निचला भाग विलयन है और ऊपरी भाग गैसीय है। यह मानते हैं कि निकाय गतिक साम्य में है अर्थात इन परिस्थितियों में गैसीय कणों (gaseous particles) के विलयन में जाने व इसमें से बाहर निकलने की गति समान है।
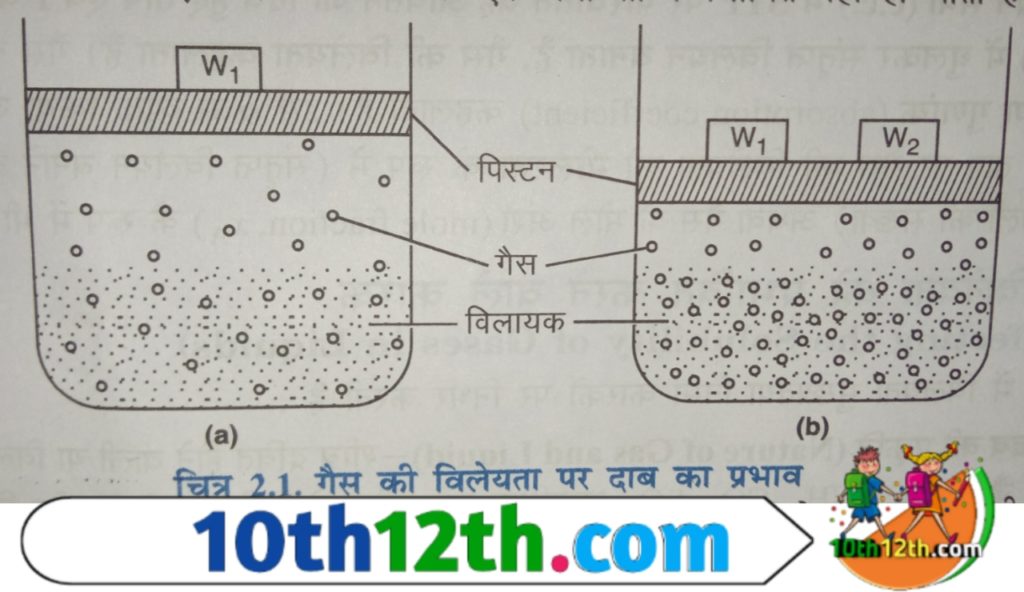
जब गैस को संपीड़ित (compress) करके विलयन पर दाब बढ़ाते हैं तब विलयन के ऊपर उपस्थित गैसीय कणों की संख्या प्रति इकाई आयतन बढ़ जाती है। जिससे गैसीय कणों की, विलयन की सतह में प्रवेश करने के लिये, इससे टकराने की दर (hitting rate) भी बढ़ जाती है। इससे गैस की विलेयता तब तक बढ़ती है जब तक कि एक नया साम्य (resemblance) में स्थापित नहीं हो जाता है। अतः दाब बढ़ाने से गैस के अणुओं की द्रव की सतह पर टकराव की वृद्धि के कारण, गैस की द्रव में विलेयता बढ़ जाती है।

